Bracco est pionnier de l’imagerie cardiaque en
Tomographie par Emission de Positons |TEP|

Cardiogen-82
Est un générateur radiopharmaceutique de rubidium-82 (demi-vie 75s)|82Rb| contenant du strontium-82 |82Sr|, adsorbé par de l’oxyde d’étain sur une colonne chromatographique. Il permet d’obtenir par élution une solution injectable stérile et apyrogène de chlorure de rubidium-82 |82Rb|.
Indications thérapeutiques3
Ce médicament est à usage diagnostique uniquement. L’éluat du générateur (solution injectable de chlorure de rubidium-82 (82Rb) est destiné à l’imagerie par Tomographie par Emission de Positons (TEP) du myocarde au repos ou sous stress pharmacologique, dans le but d’évaluer la perfusion régionale myocardique chez les adultes ayant une pathologie des artères coronaires connue ou suspectée.
Examen conduit en 30 minutes avec une acquisition des images en 5 minutes. 2,3
Dose Recommandée 3
L’activité recommandée chez un adulte est de :

Cette activité doit être adaptée selon la masse corporelle du patient, le type de caméra TEP utilisée et le mode d’acquisition des images.
Cette activité doit être administrée par perfusion intraveineuse.
Système de perfusion 1701 pour une pratique simplifiée et sécurisée
Le système de perfusion 1701 simplifie et sécurise votre examen de TEP/TDM cardiaque grâce à une technologie intelligente et automatisée :
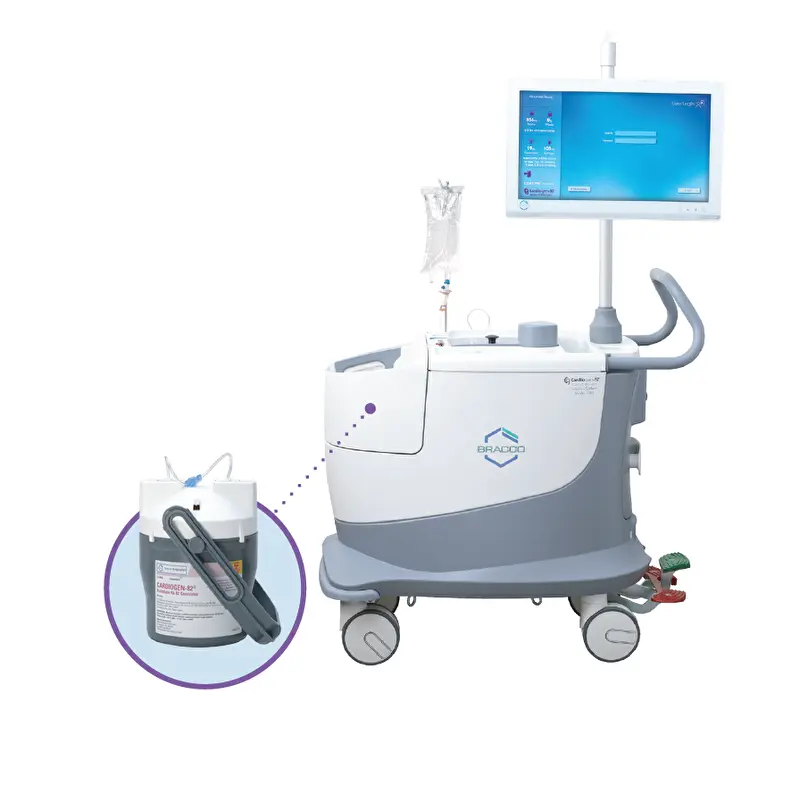
Facile à utiliser / Installation des consommables facilitée
Choix des débits d’administration
Dosage flexible sans recalibration
Autocontrôle du système avec alertes utilisateur
Enregistrements des données et des rapports avec possibilité d’impression
Contrôle de qualité intégré pouvant être réalisé en automatique pendant la nuit3 = gain de temps au début de chaque journée
Pas d’étalonnage quotidien, le système est prêt à commencer la journée avec vous.
Rinçage après perfusion pour réduire le rayonnement et diminuer l’exposition aux radiations des utilisateurs.
Le générateur Cardiogen-82 ne peut être utilisé qu’avec le système
de perfusion Cardiogen-82 / 1701.3
Cardiogen-82 a une place dans la stratégie diagnostique, au même titre que la TEMP lorsque les recommandations en vigueur prévoient la réalisation d’une scintigraphie de perfusion myocardique.9
.
.
Qualité des images et performance diagnostique1
Haute résolution spatiale et haute résolution en contraste pour une qualité d’image élevée5
TEP cardiaque avec 82Rb, une technique performante pour la détection de la maladie coronarienne obstructive6
Correction d’atténuation fiable et précise pour diminuer les faux positifs, et augmenter ainsi la spécificité.2,5,9
- Une bonne qualité de l’image et de la détection de la maladie coronarienne chez les femmes et les patients obèses.1,7
- Possibilité de calculer le débit sanguin myocardique au repos et à l’effort permettant l’évaluation de la maladie coronarienne, en fournissant des informations diagnostiques et pronostiques fiables.5,8,9
Différentes études et référentiels ont été publiés, notamment par :
- L’association européenne de médecine nucléaire |EANM|
- La société de médecine nucléaire et d’imagerie moléculaire |SNMMI|
- La société américaine de cardiologie nucléaire |ASNC| qui ont permis de normaliser son utilisation.1,2,8
PX0835 - 25/01/62491517/PM/001
Contre-indications du Cardiogen-82
Hypersensibilité à la substance active ou à l’un des excipients. Grossesse.
Effets indésirables du Cardiogen-82
Aucun évènement indésirable associé à Cardiogen-82 n’a été observé lors de l’étude clinique. L’exposition à des rayonnements ionisants peut induire un cancer ou le développement de déficiences héréditaires. La dose efficace étant de 6 mSv lorsque la radioactivité cumulée maximale recommandée de 4440 MBq est administrée, la probabilité de survenue de ces effets indésirables est considérée comme peu probable. Une exposition involontaire des patients aux radiations ionisantes due à une contamination par le strontium peut survenir pour les patients recevant du chlorure de rubidium 82Rb issu du générateur Cardiogen-82 lorsque le contrôle de qualité n’est pas réalisé correctement sur le site d’administration. Les directives concernant le contrôle de qualité sur les sites d’administration doivent être scrupuleusement respectées (voir mentions légales complètes).
Mises en garde
Possibilité de réactions d’hypersensibilité ou anaphylactiques : En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit doit être immédiatement arrêtée et un traitement par voie intraveineuse doit êtremis en place, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à dispositionimmédiate les médicaments, le personnel et le matériel nécessaires, notamment une sonde d’intubation trachéale et du matériel de ventilation. Justification individuelle du rapport bénéfice/risque : Pour chaque patient, l’exposition aux radiations ionisantes doit pouvoir être justifiée par le bénéfice attendu. Dans tous les cas, l’activité administrée doit être aussi faibleque possible raisonnablement pour obtenir les informations diagnostiques requises. Insuffisants cardiaques : Lors de l’injection, une attention particulière doit être portée aux patients présentant une insuffisance cardiaque congestive, du fait de l’augmentationtransitoire du volume sanguin. Population pédiatrique : La sécurité et l’efficacité du chlorure de rubidium 82Rb chez l’enfant n’ont pas été établies. L’administration chez l’enfant doit faire l’objet d’une attention particulière, car la dose efficace parMBq est plus élevée chez les enfants que chez les adultes. Préparation du patient : Le patient doit être à jeun depuis au moins 6 heures et être bien hydraté avant le début de l’examen. En outre, le patient ne doit pas consommer de produits alimentaires contenant de la caféine et/ou des dérivés de xanthine pendant au moins 12 heures avant l’examen. La prise de médicaments qui pourraient influencer les résultats de l’imagerie sous stress pharmacologique doit être évitée/arrêtée au moins un jour avantledébut de l’examen selon l’avis du médecin nucléaire/spécialiste en médecine nucléaire en charge et de l’indication de l’examen. Après l´examen TEP : Du fait de la demi-vie très brève, il n’y a pas de précautions particulières à prendre visà-vis de la radioactivité. Mises en garde spécifiques : La solution injectable de chlorure de rubidium (82Rb) est prévue pour une administration par voie intraveineuse uniquement au moyen d’un système de perfusion adéquat, permettant des mesures et une administration d’activités précises de chlorure de rubidium (82Rb) ne devant pas dépasser en activité unique, 2220 MBq eten activité cumulée 4440 MBq sous un débit de 50 mL/minute, avec un volume maximum par perfusion de 100 mL, et un volume total ne devant pas dépasser 200 mL.
Précautions d’emploi
La solution de chlorure de rubidium (82Rb) contient du sodium. En fonction du moment de l’injection, la teneur en sodium administrée peut être supérieure à 1 mmoldans certains cas. En tenir compte chez les patients suivant un régime hyposodé strict. La solution de chlorure de rubidium (82Rb) contribue à une exposition cumulée aux radiations ionisantes.
BIBLIOGRAPHIE
- Sciagra R et al. Eur J Nucl Med Mol Imaging. 2021; 48: 1040-1069
- Dilsizian V et al. J Nucl Cardiol. 2016; 23: 1187-1226RCP Cardiogen
- RCP Cardiogen-82
- Schleipman AR et al. Nucl Cardiol 2006; 13: 378-84
- Schindler TH et al. J Nucl Med. 2020; 6-8: 1221-1265
- McArdle BA et al. JACC. Vol. 60, 18, 2012
- Hyafil F et al. J Nucl Cardiol. 2020 Jun; 27 (3): 755-768
- Murthy VL et al. J Nucl Cardiol. 2018 25 (1): 269-297
- Avis de la commission de transparence – 20 octobre 2021
Retrouvez les mentions légales du Cardiogen-82 en cliquant ici
Retrouvez l’Avis de la Commission de la Transparence du Cardiogen-82 en cliquant ici
Pour plus d’information, merci de nous contacter vie le formulaire ci-dessous:
Cardiogen-82 - Mentions Légales
Composition : Cardiogen-82 est un générateur radiopharmaceutique de rubidium-82 (82Rb) contenant du strontium-82 (82Sr), adsorbé par de l’oxyde d’étain sur une colonne chromatographique. Il permet d’obtenir par élution une solution injectable stérile et apyrogène de chlorure de rubidium-82 (82Rb). L’activité du générateur est comprise entre 3,3 et 5,6 GBq de 82Sr à heure de calibration. Excipient : Solution pour élution : chlorure de sodium 9 mg/mL ; matrice de la colonne : oxyde stannique hydraté. Indications thérapeutiques : Ce médicament est à usage diagnostique uniquement. L’éluat du générateur (solution injectable de chlorure de rubidium-82 (82Rb)) est destiné à l’imagerie par Tomographie par Emission de Positons (TEP) du myocarde au repos ou sous stress pharmacologique, dans le but d’évaluer la perfusion régionale myocardique chez les adultes ayant une pathologie des artères coronaires connue ou suspectée. Posologie et mode d’administration : Chez l’adulte et le sujet âgé : activité recommandée chez un adulte : de 1100 à 2220 MBq (à adapter selon la masse corporelle du patient, le type de caméra TEP utilisée et le mode d’acquisition des images). Administrer par perfusion intraveineuse. Insuffisance rénale et hépatique : Une diminution de la fonction hépatique ou rénale altérant la clairance de la solution de chlorure de rubidium 82Rb n’est pas attendue, car le 82Rb décroît en gaz 82Kr stable avec une demi-vie de 75s et le gaz 82Kr est naturellement expiré par voie respiratoire. Population pédiatrique : sécurité et efficacité chez les enfants n’ont pas été établies. Mode d’administration : Administration intraveineuse par perfusion. Utilisation avec un système de perfusion approprié conçu spécifiquement pour être utilisé avec le générateur Cardiogen-82 : système de perfusion Cardiogen-82 modèle 510 ou modèle 1701. Administration avec un débit de 50 mL/min (modèle 510 ou modèle 1701) ou de 20 mL/minute (modèle 1701 uniquement), au moyen d’un cathéter posé dans une large veine périphérique, en ne dépassant pas un volume total de 100 mL. Ne jamais dépasser la vitesse d’élution de 50 mL/min, ce qui pourrait conduire à un relargage de strontium 82Sr. Acquisition des images : deux doses distinctes (étude au repos et étude lors d’une épreuve pharmacologique). Contre-indications : Hypersensibilité à la substance active ou à l’un des excipients. Grossesse. Mises en garde : Possibilité de réactions d’hypersensibilité ou anaphylactiques : En cas de réaction d’hypersensibilité ou de réaction anaphylactique, l’administration du produit doit être immédiatement arrêtée et un traitement par voie intraveineuse doit être mis en place, si nécessaire. Afin de permettre une prise en charge rapide en cas d’urgence, il convient d’avoir à disposition immédiate les médicaments, le personnel et le matériel nécessaires, notamment une sonde d’intubation trachéale et du matériel de ventilation. Justification individuelle du rapport bénéfice/risque : Pour chaque patient, l’exposition aux radiations ionisantes doit pouvoir être justifiée par le bénéfice attendu. Dans tous les cas, l’activité administrée doit être aussi faible que possible raisonnablement pour obtenir les informations diagnostiques requises. Insuffisants cardiaques : Lors de l’injection, une attention particulière doit être portée aux patients présentant une insuffisance cardiaque congestive, du fait de l’augmentation transitoire du volume sanguin. Population pédiatrique : La sécurité et l’efficacité du chlorure de rubidium 82Rb chez l’enfant n’ont pas été établies. L’administration chez l’enfant doit faire l’objet d’une attention particulière, car la dose efficace par MBq est plus élevée chez les enfants que chez les adultes. Préparation du patient : Le patient doit être à jeun depuis au moins 6 heures et être bien hydraté avant le début de l’examen. En outre, le patient ne doit pas consommer de produits alimentaires contenant de la caféine et/ou des dérivés de xanthine pendant au moins 12 heures avant l’examen. La prise de médicaments qui pourraient influencer les résultats de l’imagerie sous stress pharmacologique doit être évitée/arrêtée au moins un jour avant le début de l’examen selon l’avis du médecin nucléaire/spécialiste en médecine nucléaire en charge et de l’indication de l’examen. Après l´examen TEP : Du fait de la demi-vie très brève, il n’y a pas de précautions particulières à prendre vis-à-vis de la radioactivité. Mises en garde spécifiques : La solution injectable de chlorure de rubidium (82Rb) est prévue pour une administration par voie intraveineuse uniquement au moyen d’un système de perfusion adéquat, permettant des mesures et une administration d’activités précises de chlorure de rubidium (82Rb) ne devant pas dépasser en activité unique, 2220 MBq et en activité cumulée 4440 MBq sous un débit de 50 mL/minute, avec un volume maximum par perfusion de 100 mL, et un volume total ne devant pas dépasser 200 mL. Précautions d’emploi : La solution de chlorure de rubidium (82Rb) contient du sodium. En fonction du moment de l’injection, la teneur en sodium administrée peut être supérieure à 1 mmol dans certains cas. En tenir compte chez les patients suivant un régime hyposodé strict. La solution de chlorure de rubidium (82Rb) contribue à une exposition cumulée aux radiations ionisantes. Effets indésirables : Aucun évènement indésirable associé à Cardiogen-82 n’a été observé lors de l’étude clinique. L’exposition à des rayonnements ionisants peut induire un cancer ou le développement de déficiences héréditaires. La dose efficace étant de 6 mSv lorsque la radioactivité cumulée maximale recommandée de 4440 MBq est administrée, la probabilité de survenue de ces effets indésirables est considérée comme peu probable. Une exposition involontaire des patients aux radiations ionisantes due à une contamination par le strontium peut survenir pour les patients recevant du chlorure de rubidium 82Rb issu du générateur Cardiogen-82 lorsque le contrôle de qualité n’est pas réalisé correctement sur le site d’administration. Les directives concernant le contrôle de qualité sur les sites d’administration doivent être scrupuleusement respectées (voir mentions légales complètes).Classe pharmacothérapeutique : Liste I. Médicament réservé à l’usage hospitalier. Agréé Coll.Les produits radiopharmaceutiques ne doivent être utilisés que par des personnes qualifiées. Ils ne peuvent être délivrés qu’à des praticiens ayant obtenu l’autorisation spéciale prévue à l’article R 1333-13 du Code de la Santé Publique. Date de révision : février 2024. Bracco Imaging France – 7, rue Léonard de Vinci – 91300 Massy. CG-QR-2024-V1.
Système d'injection et autres DM de Cardiogen-82 : Ce dispositif médical est un produit de santé réglementé qui porte, au titre de cette règlementation, le marquage CE. Les performances et caractéristiques revendiquées au titre de la destination du DM : Le système de perfusion Cardiogen-82® - 1701 est conçu pour être utilisé avec le générateur Cardiogen-82® pour administrer une injection d’éluat radiopharmaceutique de chlorure de rubidium (Rb-82) à un patient. Classe : IIb pour le système de perfusion 1701 / IIa pour le Dispositif d'administration au patient N01506 et le pack d’accessoires N01710 / I pour les accessoires restants. Organisme notifié : BSI (CE 2797). Fabricant : Bracco Diagnostics Inc. – 259 Prospect Plains Road, Bldg.H – Monroe Township – New Jersey 08831 – USA. Mandataire : ACIST Europe B.V. – Argonstraat 3 – 6422PH Heerlen - Pays-Bas. L’utilisation est réservée aux personnes formées. Lire attentivement la notice.
Vos données personnelles sont traitées par Bracco Imaging France, basé au 7 rue Léonard de Vinci - 91300 Massy, à des fins de prospection, promotion et gestion des relations et échanges avec vous en fonction de vos centres d’intérêts, de communication de nature promotionnelle, institutionnelle, médicale ou scientifique, pour vous convier à des manifestations ou vous proposer de participer à des enquêtes ou études de marché (email, courrier ou téléphone), ainsi que de gestion de vos réclamations relatives à la qualité de l’information délivrée par Bracco.
Vous pouvez accéder à vos données, demander leur rectification ou leur effacement, ainsi que limiter leur traitement. Vous pouvez vous opposer au traitement de vos données et demander ou à être retiré de notre base « prospects » ou de nos listes de diffusion sans avoir à vous justifier.
Pour exercer vos droits, veuillez contacter le DPO de Bracco : [email protected].
Pour en savoir plus sur le traitement de vos données, veuillez consulter notre site internet https://www.bracco.com/fr-fr/donnees-personnelles
